本文内容速览:
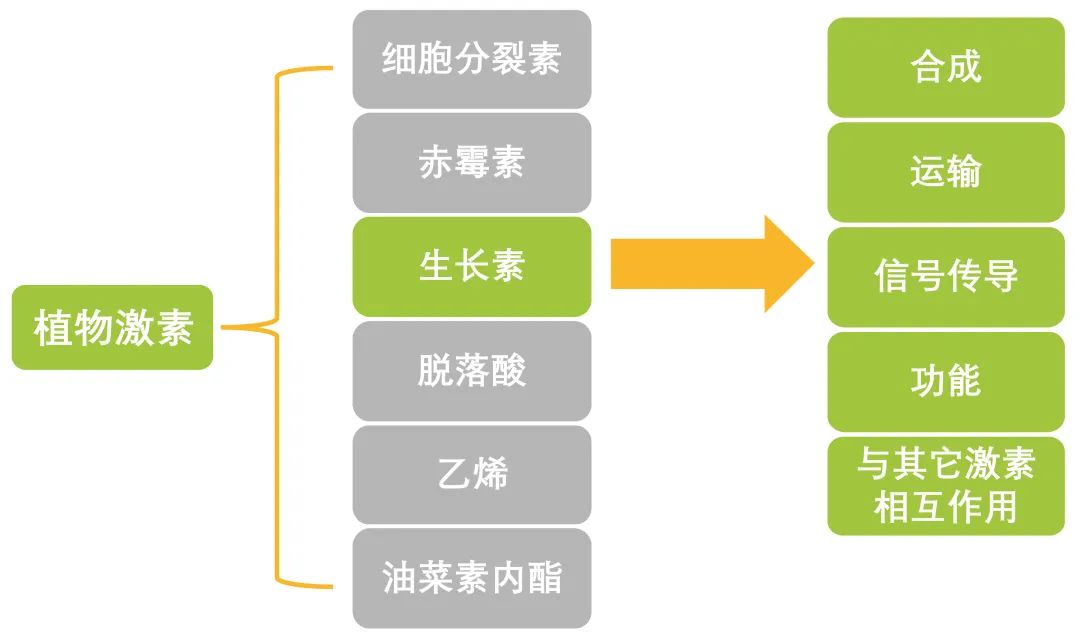
植物激素是调节植物生长、发育和环境应激反应等关键方面的信号化合物。植物体内常见的植物激素有生长素、赤霉素、细胞分裂素、脱落酸、乙烯和油菜素内酯等。不同的植物激素参与调节植物不同的生命活动过程,某一植物激素除了单独发挥调节作用外还可以与其它植物激素以协同作用或拮抗作用的方式来参与调节植物的生命活动。近年来,围绕着植物激素研究的文章层出不穷,已经在许多物种中都有相关的报道。本文主要为大家介绍植物激素中的老大哥--生长素,主要围绕生长素的合成、运输、信号传导和功能等方面,希望通过本文的介绍,能让大家对生长素有个更清晰的了解。接下来就让伯小远带你走进生长素的世界。
1.什么是生长素?
生长素(Auxin)是最早发现的植物激素之一,也是研究最广泛的植物激素之一,它是一类含有一个不饱和芳香族环和一个乙酸侧链的内源激素,在植物生长发育过程中发挥重要作用。
生长素参与植物细胞的伸长和分裂、主侧根和下胚轴的生长、植株向地性和向光性的形成以及根毛和花器官的形成等生命过程,对植物早期生长发育和形态建成均具重要意义。生长素不仅在植物的生长发育和环境适应中发挥作用,而且还是协调不同组织甚至不同细胞之间交流的重要信号分子。
2.生长素的合成
吲哚乙酸(indole-3-acetic acid,IAA)是植物生长素最主要的形式。IAA的生物合成主要发生在幼嫩的部位,如嫩叶、嫩茎、根系以及正在生长的果实等,其中嫩叶是主要的合成部位。IAA的生物合成可以分为色氨酸(Trp)依赖途径和Trp非依赖途径。
IAA可以通过Trp合成,称为Trp依赖途径。根据不同路径的中间产物,可以将其分为吲哚乙醛肟(indole-3-acetaldoxime,IAOx)途径、吲哚乙酰胺(indole-3-acetamide,IAM)途径和吲哚丙酮酸(indole-3-pyruvic acid,IPA)途径等。
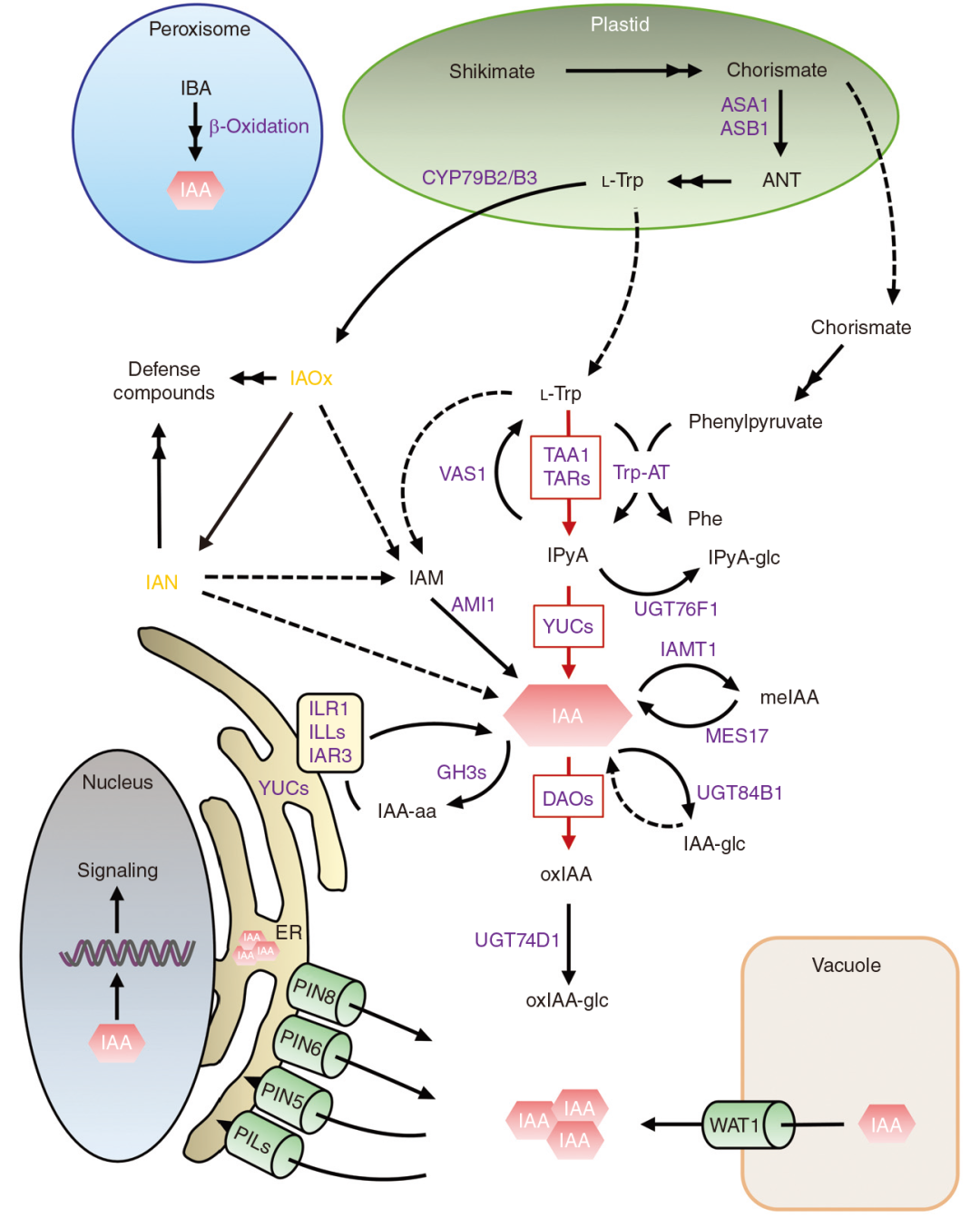
图1. 植物IAA代谢的主要途径(Casanova-Sáez et al., 2021)。
IAOx途径又称CYP79B途径,因为细胞色素 P450(CYP)家族成员CYP79B2和CYP79B3在该途径中具有重要的作用,能够催化Trp转化形成IAOx(Hull et al., 2000)。在芸薹属植物中,研究人员发现 SUR1和SUR2基因编码的蛋白能够催化IAOx形成吲哚族硫代葡萄糖甙(indolyl glucosinolate, IG)。IG能被黑芥子酶催化水解生成吲哚-3-乙腈(indole-3-acetonitrile,IAN),IAN可经腈水合酶(nitrile hydratase,NIT)酶解最终形成IAA(Sugawara et al., 2009)。
目前普遍认为IAOx途径不是生长素合成的主流途径,主要有以下几个观点:(1)在水稻和玉米等植物中并没有发现CYP79B的同源基因;(2)cy79b2 cy79b3双突变体生长素缺陷的表型相比于其它信号转导途径成员并不明显。
IAM途径是在微生物中研究最清楚的一条途径。最早在根癌农杆菌(Agrobacterium tumefaciens)和丁香假单胞菌(Pseudomonas syringae)中发现,在该途径中,色氨酸单加氧酶(tryptophan monooxygenase,iaaM)催化Trp转化形成IAM,随后吲哚乙酰胺水解酶将IAM水解形成IAA(Patten et al., 2013)。目前,在小麦、水稻等植物中也检测到IAM的存在,这表明IAM途径在植物中也广泛存在。此外,IAM还是IAOx转化形成IAA这一途径中的一个重要中间产物。
IPA途径也是微生物合成生长素的一种重要方式,目前在植物中也多有报道。Tao在筛选避荫反应缺陷突变体时鉴定到一个sav3突变体,SAV3编码一个氨基转移酶的同源蛋白,为该蛋白具有催化Trp转化为IPA的活性,所以将其命名为色氨酸转移酶(Tryptophan Amino Transferase of Arabidopsis,TAA1)(Tao et al., 2008)。在微生物中,色氨酸在TAA蛋白的催化下生成IPA,吲哚乙醛(Indole-3-acetaldehyde,IAAId)催化IPA转变成IAA(Woodward et al., 2005);在植物中,TAA基因家族与YUC基因家族共同协调参与IAA的合成,YUC蛋白将IPA催化最终生成IAA(Mashiguchi et al., 2011)。
除了Trp依赖途径外,IAA也可以通过Trp非依赖途径合成。在拟南芥trp1突变体中,磷酸核糖基转移酶(phosphoribosylanthranilate transferase,PAT)缺陷引起下游生长素合成酶吲哚-3-甘油磷酸合成酶(indole-3-glycerol phosphate synthase,IGS)和吲哚-3-甘油磷酸酯(indole-3-glycerol phosphate,IGP)表达水平的下降,最终突变体中只有较低水平的Trp和IAA含量。然而在拟南芥trp3和trp2突变体中,分别缺失了色氨酸合成酶α(tryptophan synthase α,TSA)和色氨酸合成酶β(tryptophan synthase β,TSB),虽然Trp含量很低,但是IAA含量却明显高于野生型,这些结果证实了Trp非依赖途径的存在(Woodward et al., 2005)。在拟南芥中,存在一种定位在细胞质的吲哚合酶,是TSA的同源基因,以Trp非依赖途径参与催化细胞质中的IGP转化形成吲哚,最终形成生长素(Wang et al., 2015)。
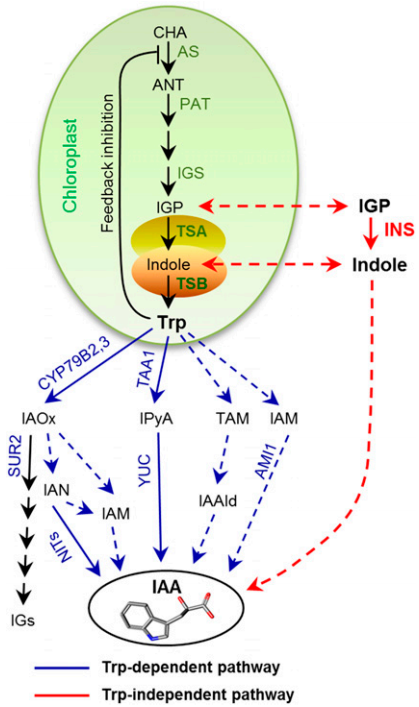
3.生长素的运输
生长素在植物幼嫩的部位合成后运输到植物的各个部位,从而调控其所介导的一系列生命活动过程。生长素的运输可以分为两种途径:不固定运输方向的被动运输和固定运输方向的极性运输。植物发育过程很大程度上是由生长素梯度分布引起,而这种梯度分布正是由生长素极性运输所维持的。生长素的极性运输特性是确保植物进行极性生长与有效响应环境刺激的重要基础。
生长素极性运输由3类转运蛋白介导完成,包括生长素输入载体Aux1/LAX、ABCB 转运蛋白和生长素输出载体PIN。局部生长素的新陈代谢导致其含量与浓度升高,引起具有显著方向性的细胞—细胞间的运输,植物体中的生长素输入载体与输出载体通过协调作用从而实现生长素的跨膜运输。其中,PIN 蛋白的质膜极性分布模式在调节生长素不对称分布方面起着重要作用,是决定生长素极性运输方向的关键调控因子(Park et al., 2017)。
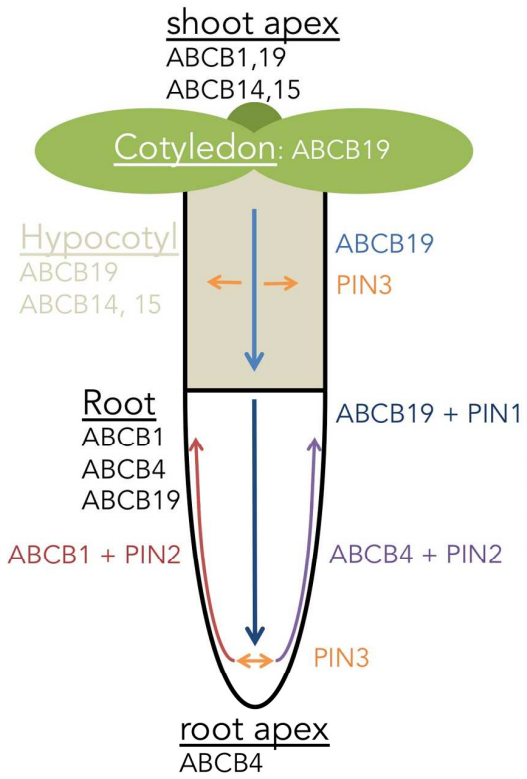
图3. 拟南芥中生长素极性运输(Geisler et al., 2017)。
4.生长素的信号转导
生长素信号转导是一个转录调控的过程,TIR1/AFBs 介导的生长素转录调控,也称为经典的生长素信号转导,是研究最广泛、表征最好的生长素信号通路。该反应由三个核心信号转导成分介导:生长素受体复合体TIR1/AFBs、生长素阻遏蛋白Aux/IAAs和生长素响应因子ARFs。在低生长素浓度条件下,Aux/IAAs招募TPL/TPRs和HDACs,导致染色质去乙酰化和染色质收缩,进而影响ARFs与靶基因启动子中生长素响应元件(AuxREs)的结合,引起基因转录抑制;在高生长素浓度条件下,生长素与生长素受体SCFTIR1/AFBs结合并识别特异性靶标Aux/IAAs形成SCFTIR1/AFBs-Aux/IAAs复合物,26S蛋白酶体泛素化 Aux/IAAs使其降解,释放TPL/TRPs、HDACs和ARFs,启动下游基因的转录(Yu et al., 2022)。
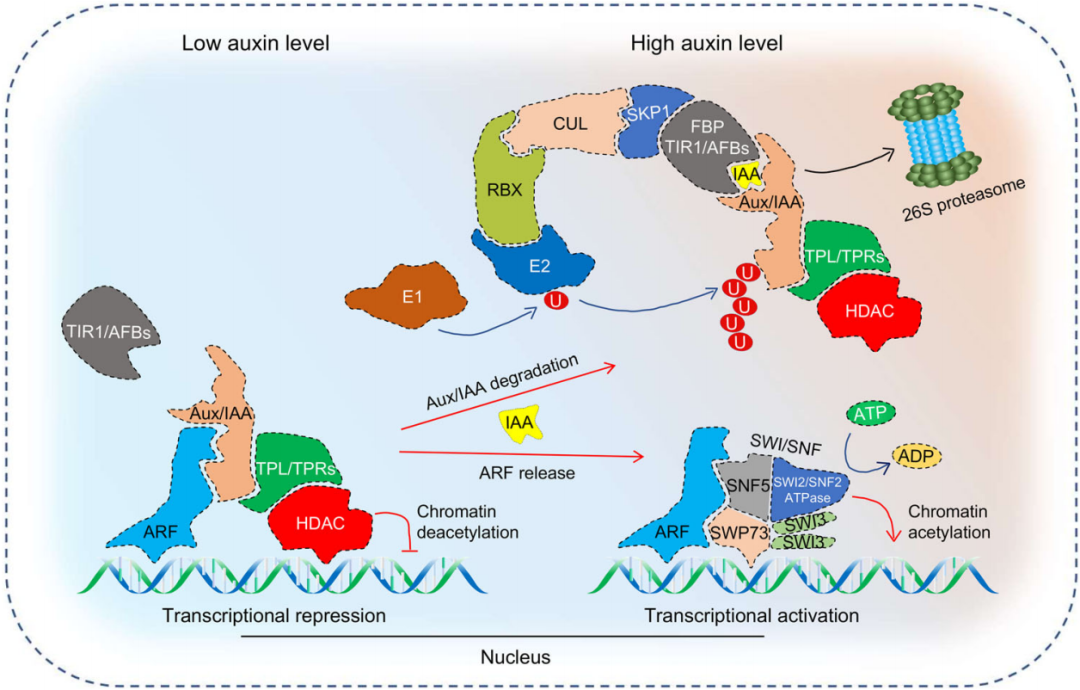
图4. 经典的生长素信号转导途径(Yu et al., 2022)。
在Aux/IAAs家族中存在部分蛋白由于缺失结构域而无法被TIR1/AFBs识别,因此它们不能参与经典的生长素信号转导途径。例如TMK1-IAA32/34-ARFs途径和MPK14-IAA33-ARFs途径等,它们主要由蛋白质磷酸化来介导。在TMK1-IAA32/34-ARFs途径中,高浓度生长素诱导质膜定位的跨膜激酶(transmembrane kinase 1,TMK1)羧基端(C-)发生剪切,导致TMK1的C末端转移到细胞核中,非经典Aux/IAAs家族成员IAA32/34被TMK1的C末端特异性磷酸化,磷酸化的IAA32/34与ARFs互作,参与调控下游基因表达;在MPK14-IAA33-ARFs途径中,高浓度生长素激活丝裂原活化蛋白激酶14(mitogen-activated protein kinase14,MPK14)磷酸化并稳定非经典IAA33,提高了IAA33与经典IAA5竞争性结合下游抑制因子ARF10/ARF16的能力(Cui et al., 2023)。
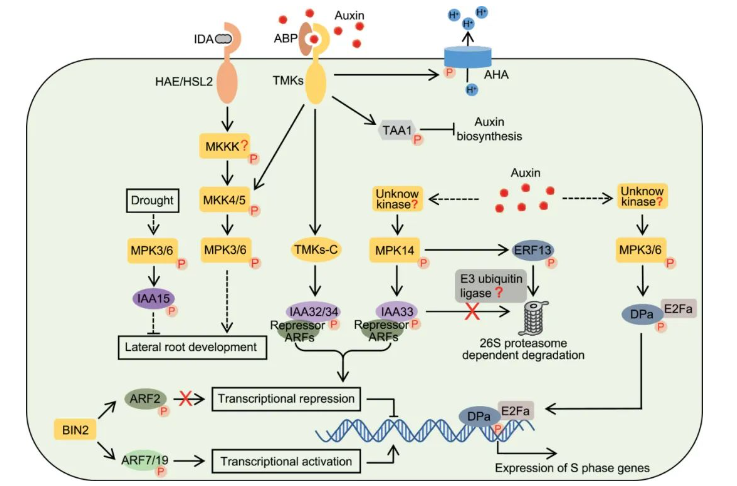
图5. 非经典的生长素信号转导途径(Cui et al., 2023)。
5.生长素的功能
生长素已经被广泛报道参与植物的生长发育和环境适应过程。接下来由伯小远给大家介绍下在近两年的研究中在不同物种中生长素都发挥着什么样的功能。
植物的生长发育过程是一个很漫长的过程,不仅包括微观结构的细胞伸长和细胞增殖过程,还包括宏观结构的根、茎、叶、花和果实等器官的形态建成过程。2022年,山东大学生命科学学院丁兆军课题组在Journal of integrative plant biology上发表了题为“A feedback regulation between ARF7-mediated auxin signaling and auxin homeostasis involving MES17 affects plant gravitropism”的研究论文。作者发现ARF7介导的生长素信号刺激下胚轴下侧甲基转移酶基因MES17的表达,MES17能够将生长素从非活性形式转化为活性形式的游离IAA,从而造成下胚轴上下两侧快速建立生长素的浓度梯度进而促进其弯曲生长(Zhang et al., 2022)。
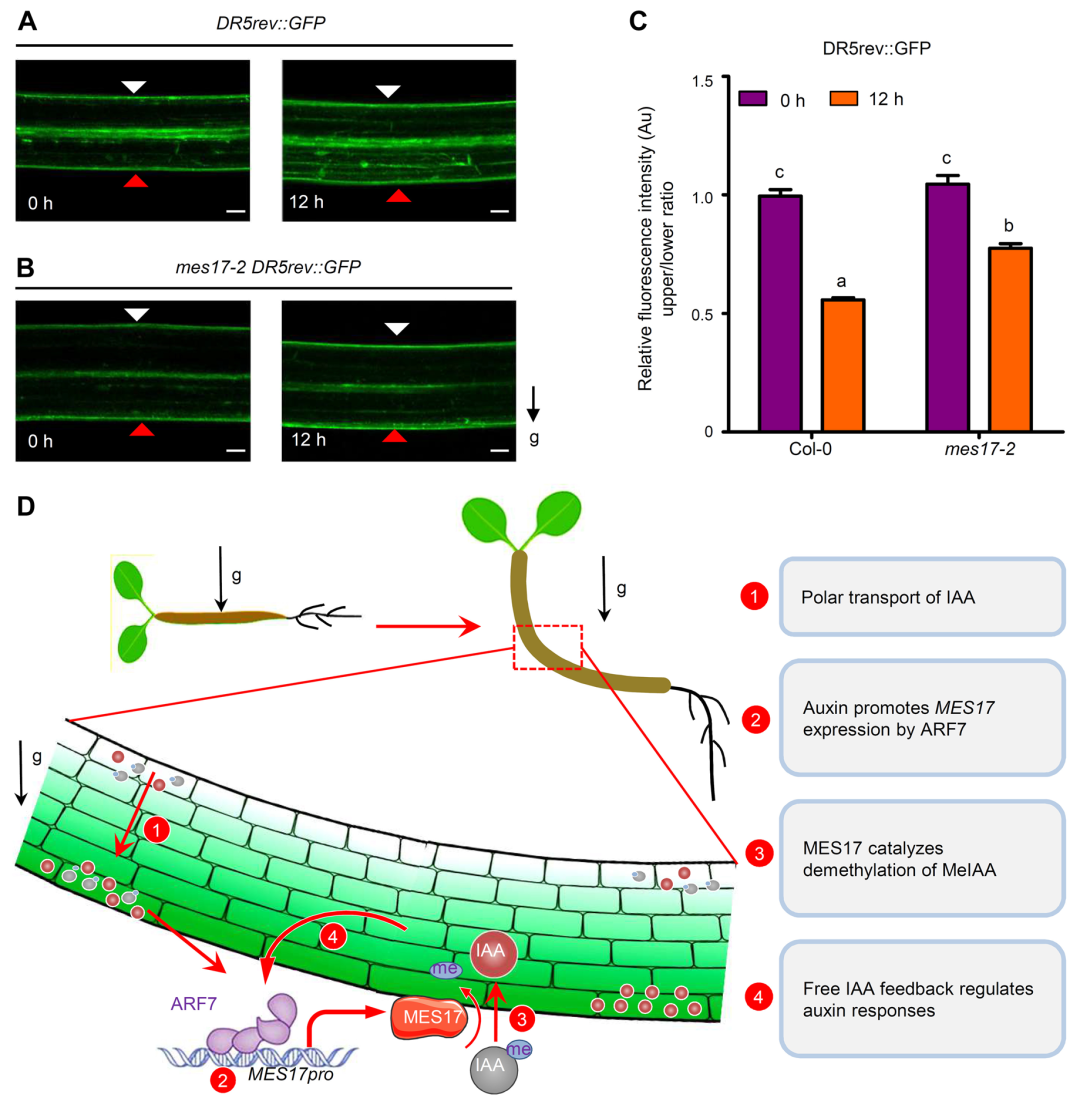
图6. MES17对生长素信号的反馈调控(Zhang et al., 2022)。(A-B)重力刺激前(0h)和重力刺激后(12h),Col-0(A)和 mes17-2(B)幼苗下胚轴中的 DR5rev:GFP 报告者的荧光模式。白色三角形表示下胚轴上部,红色三角形表示下部。g 代表重力,箭头表示重力方向。(C)、(A)和(B)中所示 Col-0 和 mes17-2 下胚轴在重力刺激 12 小时前后的相对绿色荧光蛋白(GFP)信号强度。(D)MES17 在下胚轴重力定向过程中的作用模型。
2021年,上海交通大学生命科学技术学院张大兵课题组在The Plant Cell上发表了题为“AUXIN RESPONSE FACTOR 6 and 7 control the flag leaf angle in rice by regulating secondary cell wall biosynthesis of lamina joints”的研究论文。作者通过对osarf6和osarf17突变体进行观察,发现突变体叶片关节细胞次生细胞壁水平降低,导致旗叶角度夸大。进一步研究发现生长素响应因子OsARF6和OsARF17通过独立或协同的方式激活水稻旗叶夹角调控基因ILA1的表达参与水稻旗叶角度调控(Huang et al., 2021)。
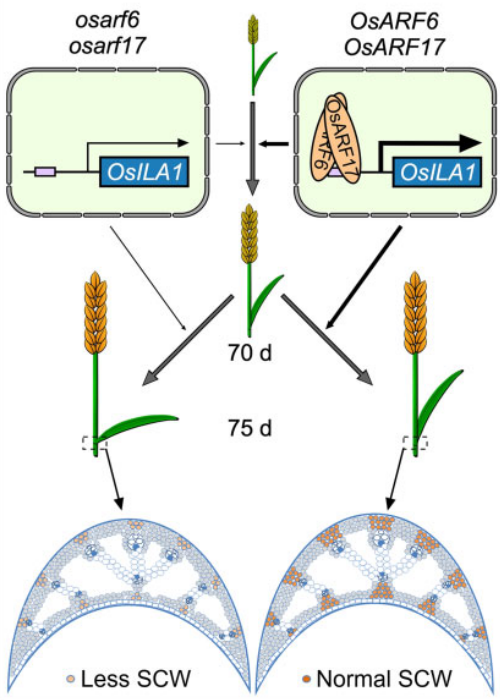
图7. OsARF6和OsARF17调控水稻旗叶角度的模型(Huang et al., 2021)。
2023年,南京农业大学园艺学院吴俊老师课题组在Plant Biotechnology Journal上发表了题为“Auxin inhibits lignin and cellulose synthesis in stone cells of pear fruit via the PbrARF13-PbrNSC-PbrMYB132 transcriptional regulatory cascade”的研究论文。该研究发现外源喷施NAA能够抑制梨果实中石细胞木质素和纤维素合成关键基因PbrNSC 的表达,此外PbrNSC的表达还受到生长素反应因子PbrARF13的抑制,PbrNSC还能抑制PbrMYB132的表达。基于此,作者最终阐述了‘PbrARF13-PbrNSC-PbrMYB132’ 级联信号途径在NAA抑制梨果实石细胞形成的过程中发挥着重要的作用(Xu et al., 2023)。
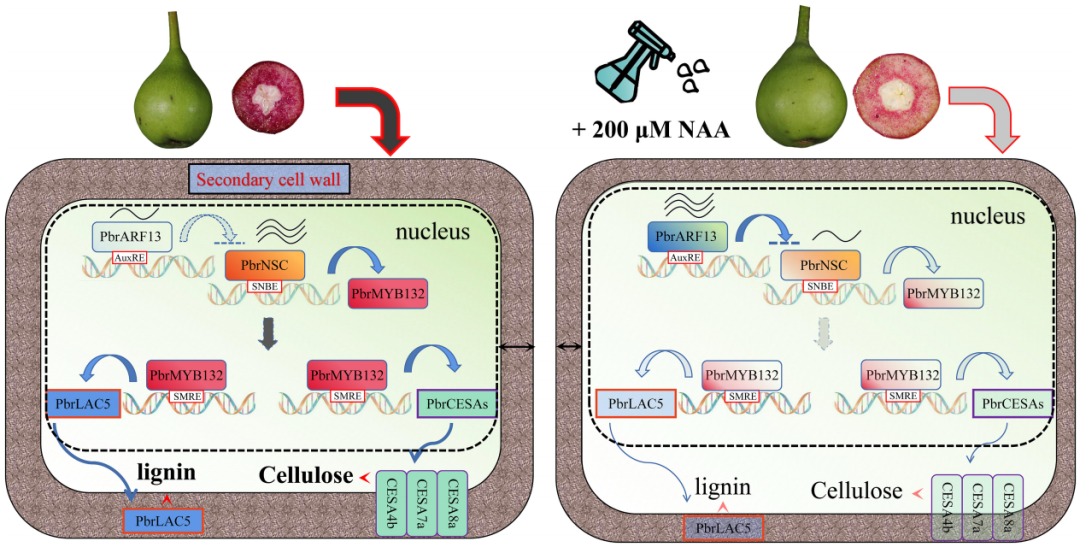
图8.外源喷施200μM NAA抑制梨果实石细胞木质素和纤维素生物合成的分子机制模型(Xu et al., 2023)。
生物胁迫包括病原体或食草动物的攻击等,生长素在植物抵御生物胁迫过程中发挥着重要的作用。2022年,西北农林科技大学园艺学院马锋旺课题组在Horticultural Plant Journal上发表了题为“Overexpression of auxin/indole-3-acetic acid gene MdIAA24 enhances Glomerella leaf spot resistance in apple (Malus domestica)”的研究论文。作者发现过表达生长素响应基因MdIAA24能够增加苹果对苹果炭疽菌侵染的防御反应,提高苹果的抗病性(Wang et al., 2022)。
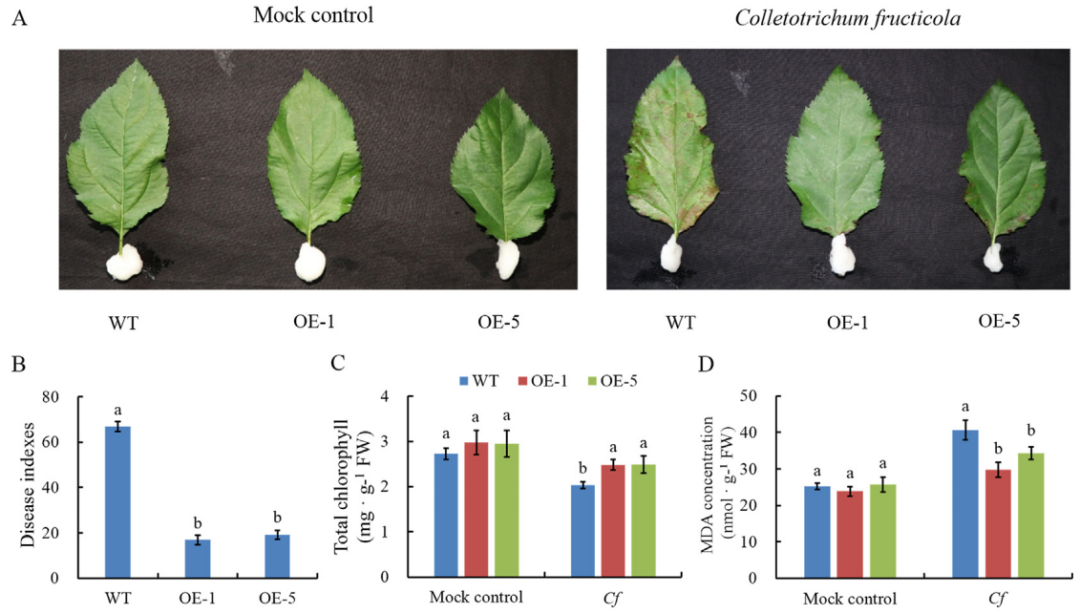
图9.过表达MdIAA24提高转基因苹果的抗病性(Wang et al., 2022)。
非生物胁迫包括低温、高温、干旱和盐胁迫等,是一种影响植物的重要环境因素,生长素在植物抵御非生物胁迫过程中同样发挥着重要的作用。2023年,南京农业大学资源与环境科学学院宣伟课题组在Nature Plants上发表了题为“Plastid-localized amino acid metabolism coordinates rice ammonium tolerance and nitrogen use efficiency”的研究论文。该研究通过正向遗传学方法从水稻中鉴定到一个受铵盐诱导的基因ASL,ASL基因能够调控水稻生长素信号和运输相关基因的表达,从而促进生长素在根尖分生区的积累进而促进水稻根系在高浓度铵态氮处理下的伸长。揭示了水稻ASL通过调控氮代谢和维持生长素稳态以促进水稻根系对铵的耐受性的分子机制(Xie et al., 2023)。
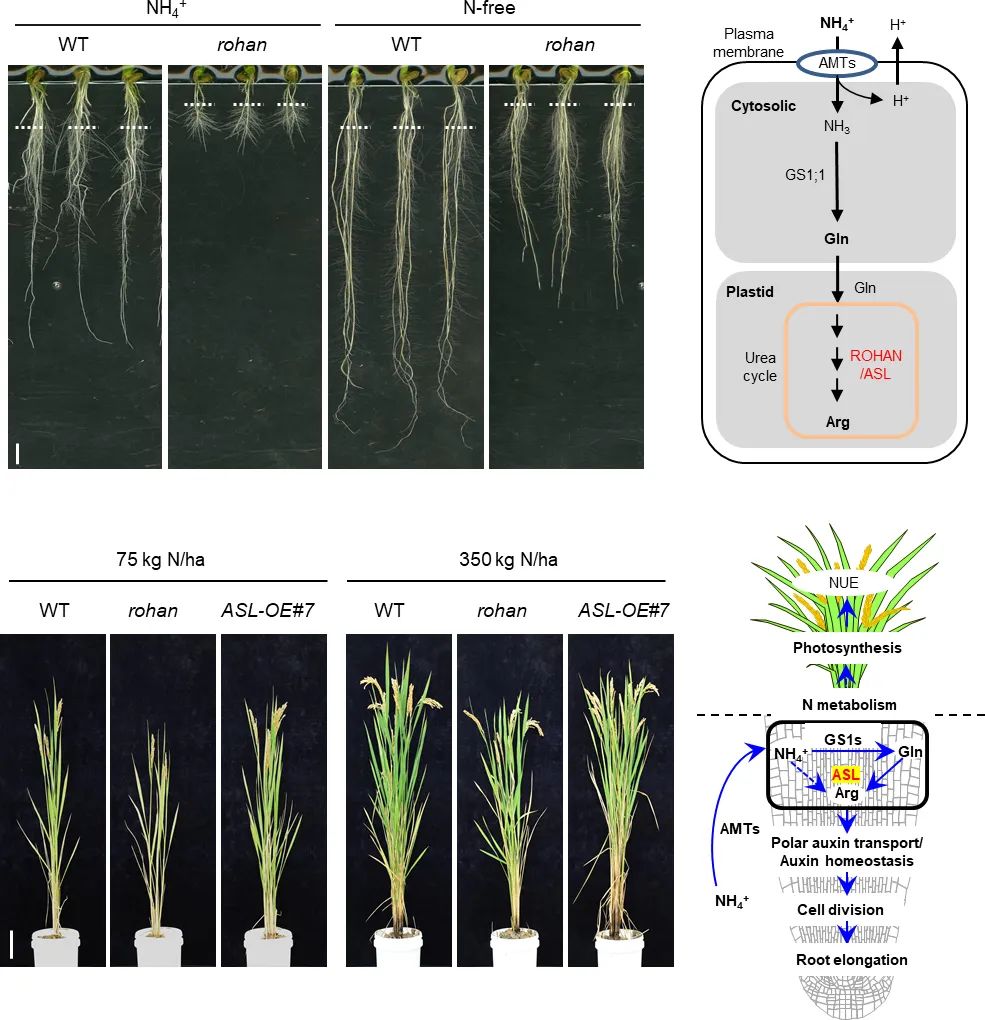
图10. ASL基因提高了水稻对NH4+和NUE的耐受性(Xie et al., 2023)。
6.生长素参与不同激素间的相互作用
生长素广泛参与植物生命活动过程,在部分生长发育阶段,生长素可能是单独发挥调控功能,在另外某些阶段,生长素又需要与其它激素共同参与调控。
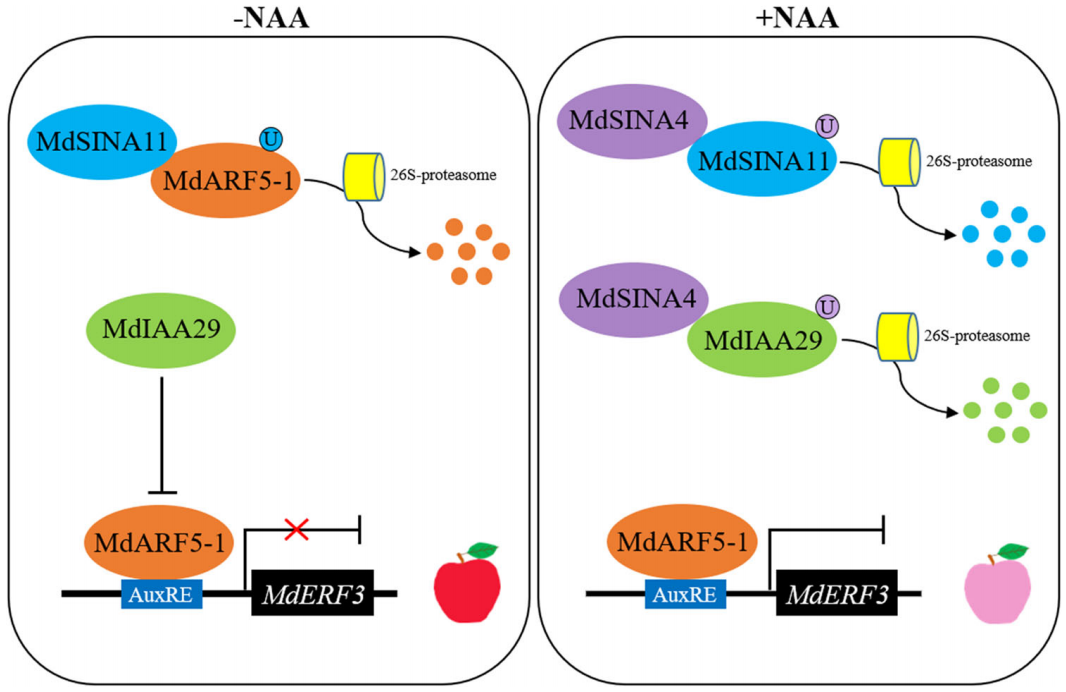
2023年,山东农业大学由春香课题组和中国科学院武汉植物园韩月彭课题组共同在Plant, Cell & Environment上发表了题为“E3 ubiquitin ligases SINA4 and SINA11 regulate anthocyanin biosynthesis by targeting the IAA29-ARF5-1-ERF3 module in apple”的研究论文。作者发现MdARF5-1通过转录抑制MdERF3的表达来整合生长素和乙烯信号,生长素信号通路阻遏蛋白MdIAA29能够减弱MdARF5-1对MdERF3的转录抑制,从而降低MdARF5-1对花青素生物合成的抑制作用。E3泛素连接酶MdSINA4和MdSINA11能够泛素化降解 MdIAA29和MdARF5-1,影响其参与花青素生物合成过程。该研究解析了苹果花青苷生物合成中MdIAA29-MdARF5-1-MdERF3模块介导的生长素和乙烯信号之间的相互作用关系(Li et al., 2023)。
2022年,重庆大学生命科学学院邓伟课题组在The Plant Cell上发表了题为“Auxin and abscisic acid antagonistically regulate ascorbic acid production via the SlMAPK8–SlARF4–SlMYB11 module in tomato”的研究论文。作者发现脱落酸(ABA)诱导SlMAPK8基因的表达。SlMAPK8能够磷酸化SlARF4抑制其转录活性,同时SlMAPK8能够磷酸化SlMYB11并激活其转录活性。SlMAPK8在ABA诱导的AsA积累和抗旱性中起作用。该研究阐明了ABA拮抗生长素对AsA积累介导胁迫耐受性中发挥着重要的作用(Xu et al., 2022)。
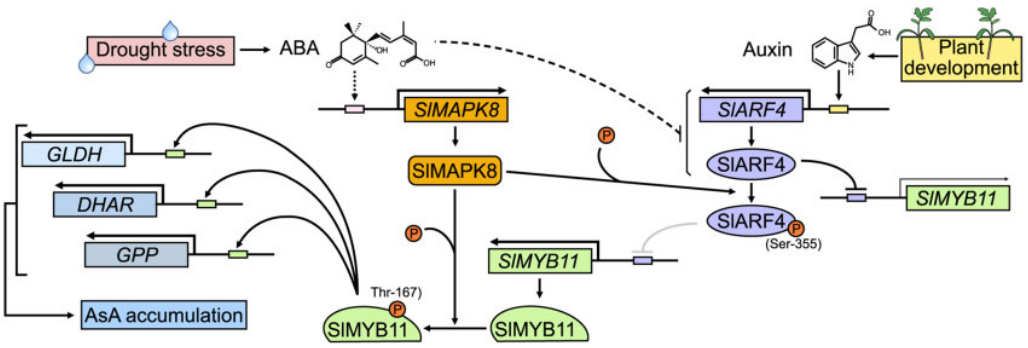
图12. 生长素和ABA调节番茄植株发育和耐旱过程的分子机制模型(Xu et al., 2022)。
2022年,陕西师范大学生命科学学院肖光辉课题组在Plant Biotechnology Journal上发表了题为“Auxin promotes fiber elongation by enhancing gibberellic acid biosynthesis in cotton”的研究论文。作者发现生长素作用于赤霉素的上游。外源喷施生长素或赤霉素均可促进棉花纤维伸长,棉花生长素响应因子 GhARF18通过直接结合赤霉素合成基因GhGA3OX4D及GhGA20OX1D-2启动子区AuxRE元件,正调控这两个赤霉素合成基因的表达,促进赤霉素的生物合成,调控棉花纤维伸长发育(Zhu et al., 2022)。
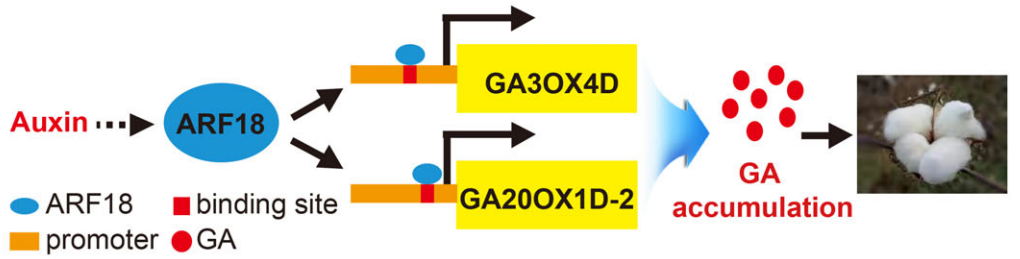
图13. 生长素和赤霉素共同调控棉花的分子机制模型(Zhu et al., 2022)。
2021年,海南大学热带作物学院施海涛课题组在Cell Reports发表题为“Heatshock protein 90 co-chaperone modules fine-tune the antagonistic interaction betweensalicylic acid and auxin biosynthesis in cassava”的研究论文,作者发现细菌性疾病能够诱导木薯中MeHsf8基因的表达,并靶向激活MeHSP90.9,随后MeHSP90.9一边与MeSRS1互作,促进MePBS3转录激活和相应的水杨酸的生物合成;一边与MeWRKY20相互作用,促进MeASMT2转录激活以及对生长素合成的抑制作用。该研究阐明了木薯HSP90伴侣模块调节水杨酸和生长素水平参与植物免疫过程(Wei et al., 2022)。

图14. MeHSP90.9 参与植物免疫反应的分子机制模型(Wei et al., 2022)。
行文至此,本篇文章就告一段落了,关于生长素,相信大家已经有了个基本的了解。接下来让小远带着你再次回顾一下今天的的容,在这篇文章中小远主要给大家介绍了什么是生长素、生长素的合成、运输、信号传导以及功能和生长素与其它激素的相互作用关系。我们了解到了生长素的合成机制是通过依赖Trp和不依赖Trp途径进行;我们了解到了生长素的运输方式是通过极性运输和被动运输方式进行;我们了解到了生长素的信号转导途径是通过TIR1/AFBs-Aux/IAAs-ARFs的经典途径和非经典途径进行;我们了解到了生长素能够独立或与其它激素共同协同参与植物的生长发育和环境适应过程。作为第一个被发现的植物激素,虽然生长素在某些方面仍然对我们保持着神秘感,但是相信在我们这么多优秀科学家的努力下,我们终能揭开生长素神秘的面纱!


